
3. Litium (Li) <— 4. Beryllium (Be) —> 5. Bor (B)
https://sv.wikipedia.org/wiki/Beryllium
https://en.wikipedia.org/wiki/Beryllium
Generella egenskaper
Relativ atommassa: 9,0121831 u
Utseende: Vit–grå metallisk
Fysikaliska egenskaper
Densitet (vid rumstemperatur): 1,848 g/cm3
Densitet (vid smältpunkten): 1,69 g/cm3
Aggregationstillstånd: Fast
Smältpunkt: 1 560 K (1 287 °C)
Kokpunkt: 3 243 K (2 970 °C)
Kritisk punkt: 5 205 K (4 931,85 °C) ? MPa (extrapolerad)
Molvolym: 4,85 × 10−6 m3/mol
Smältvärme: 10,456 kJ/mol
Ångbildningsvärme: 223,764 kJ/mol
Specifik värmekapacitet: 1 825 J/(kg × K)
Molär värmekapacitet: 16,443 J/(mol × K)
Atomära egenskaper
Atomradie: 105 pm
Kovalent radie: 96 pm
van der Waalsradie: 153 pm
Arbetsfunktion: 4,98 eV
Elektronkonfiguration
Elektronkonfiguration: [He] 2s2
e− per skal: 2, 2
Kemiska egenskaper
Oxidationstillstånd: 0, +1, +2
Oxider (basicitet): BeO (amfoterisk)
Elektronegativitet (Paulingskalan): 1,57
Elektronegativitet (Allenskalan): 1,576
Normalpotential: −1,97 V (Be2+ + 2 e− → Be)
Diverse
Kristallstruktur: Hexagonal tätpackad
Ljudhastighet: 12890 m/s
Termisk expansion: 11,3 µm/(m × K) (25 °C)
Värmeledningsförmåga: 190 W/(m × K)
Elektrisk konduktivitet: 31,3 × 106 A/(V × m)
Elektrisk resistivitet: 36 nΩ × m (20 °C)
Magnetism: Diamagnetisk
Magnetisk susceptibilitet: −2,3 × 10−5
Youngs modul: 287 GPa
Skjuvmodul: 132 GPa
Kompressionsmodul: 130 GPa
Poissons konstant: 0,032
Mohs hårdhet: 5,5
Vickers hårdhet: 1670 MPa
Brinells hårdhet: 590–1320 MPa
Identifikation
CAS-nummer: 7440-41-7
EG-nummer: 231-150-7
Pubchem: 5460467
UN-nummer: 1567
RTECS-nummer: DS1750000
Historia
Namnursprung: Beryll, ett mineral.
Upptäckt: Louis Nicolas Vauquelin (1797)
Första isolation: Friedrich Wöhler & Antoine Bussy (1828)
Isotoper
| Isotop | Förekomst | Halveringstid (t1/2) | Sönderfall | Sönderfallsprodukt | |
|---|---|---|---|---|---|
| 7Be | Spår | 53,22 d | ε | 7Li | |
| 8Be | {syn} | 6,7 × 10−17 s | α | 4He | |
| 9Be | 100 % | Stabil | |||
| 10Be | Spår | 1,39 × 106 y | β− | 10B | |
| 11Be | {syn} | 13,81 s | β− | 11B | |
https://en.wikipedia.org/wiki/Isotopes_of_beryllium
Beryllium
Beryllium är ett grundämne som tillhör gruppen alkaliska jordartsmetaller. Dess kemiska egenskaper avviker dock en del från de övriga alkaliska jordartsmetallerna, så att den i vissa avseenden påminner om aluminium. Beryllium är ett tämligen ovanligt grundämne, men koncentreras i vissa mineral, speciellt beryll (genomsnittsformel Be3Al2(SiO3)6), vilket är både en ädelsten och råvara till berylliumframställning. Som ädelsten kallas beryllen smaragd när den är grön, akvamarin när den är blekt blågrön och ädelberyll för alla övriga färger.[12] Även gula, rosafärgade och violetta varianter av beryll förekommer sällsynt. Färgen kommer av föroreningar i stenen. Beryllium har atomnummer 4.
Hälsofara
Beryllium och dess föreningar är utomordentligt giftiga. Inandning av berylliumdamm eller ångor från berylliumföreningar leder till lunginflammation (beryllios). Första symptom är rethosta och andnöd. Diagnos sker med röntgenundersökning kompletterat med blodprov. Vid behandling efter kortvarig exponering tillfrisknar patienten oftast efter någon vecka. Vid långvarig exponering blir skadan obotlig.
Att se upp med är kontakt med sönderslagna lysrör samt skärmar till datorer och TV-mottagare, eftersom lysämnet, som täcker glasets insida, kan innehålla beryllium.
Vid bearbetning av metallen måste åtgärder vidtas för att undvika inandning av damm och spån. Ögon och hud kan skadas av kontakt med beryllium och berylliumhaltiga föreningar. Om beryllium kommer in i ett sår, blir såret svårläkt.
Nedsväljning är harmlöst.
Vid berylliumsmitta ansamlas ämnet främst i skelettet. Utsöndring sker långsamt genom urin och avföring. Vid ett olyckstillfälle smittades samtidigt 25 personer. Uppföljning visade en biologisk halvvärdestid på 2–8 veckor.
Amerikanska myndigheten OSHA (Occupational and Health Safety Administration) har satt säkerhetsgränsen för luftförorening av beryllium till max 2 μg/m3 luft. Vid arbete med beryllium är rökning, mat och dryck förbjudet.
NIOSH (National Institute for Occupational Safety and Health) misstänker att beryllium möjligen kan vara cancerframkallande.
Risk för dammexplosion vid kontakt mot heta föremål eller utsatt för gnistor.
Historik
Beryllium identifierades som element av Louis Vauquelin 1798. Berylliummetall framställdes för första gången 1828 av Friedrich Wöhler samt oberoende av Antoine Bussy. Metoden var att reducera berylliumklorid (BeCl2) med hjälp av kalium.
Wöhler kallade det nya ämnet glucinium, med kemisk tecken Gl. Detta namn byggde på latin glucina härlett från grekiska glukus = söt, syftande på att vissa berylliumföreningar smakar sött. Tidiga forskare hade nämligen som en första indikation på berylliumförekomst smakat på berylliumföreningar, och tyckte det smakade sött. Man förstod då inte att det var giftigt och farligt.
Vauquelin kallade ämnet beryllium. Båda benämningarna förekom parallellt ända till 1957, då beryllium fastställdes som det giltiga namnet.
Egenskaper
Finfördelat beryllium är brännbart i luft, men till skillnad mot alkalimetaller och de flesta alkaliska jordartsmetaller, är beryllium så pass svårjoniserat att det inte ger någon färg när det bränns i låga.
Densiteten är visserligen 1,85 (vatten 1,0), men berylliumpulver är inte tyngre än att vattens ytspänning räcker för att hålla pulvret flytande, d v s vattnet väter ej pulvret.
Praktiskt taget olösligt i kallt vatten, men något lösligt i hett vatten. Löser sig inte i kvicksilver.
Angrips av både sura och alkaliska lösningar. Reagerar långsamt med utspädd salpetersyra. Reagerar med svavelsyra, klorvätesyra och fluorvätesyra, men påverkas knappast alls av koncentrerad (rykande) salpetersyra.
Oxideras ej vid förvaring i normal rumstemperatur.
Beryllium är smidbar upphettad till rödvärme (omkring 500 °C).
Slipning av berylliumlegeringar skapar inga gnistor. Gnistfriheten utnyttjas för gnistfria verktyg, som är avsedda för arbete i explosionsfarlig miljö.
Framställning
Vid framställning av berylliummetall omvandlar man beryllen till berylliumhydroxid (Be(OH)2) med någon metod, exempelvis urlakning med svavelsyra (H2SO4) och kokning med natriumhydroxid (NaOH). Berylliumhydroxiden omvandlas till klorid och reduceras sedan med magnesium, varvid man får oren berylliummetall som sedan renas.
Gruvor i Sverige
I Kolsva fältspatgruva, tolv kilometer norr om Köping, finns Sveriges största förekomst av berylliumminera. Under främst 1950-talet tillvaratogs här, huvudsakligen genom utskrädning av befintliga skrotstensupplag, omkring 25 ton berylliummineral, främst beryll (omkring 90 %) och krysoberyll. Detta gör gruvan till den största berylliummineraliseringen i Sverige och förmodligen störst i Europa. Genom AB Atomenergis prospekteringsverksamhet upptäcktes stora mängder berylliummineral i de djupare delarna (85–110 metersnivån) av fältspatgruvan. De större blocken med beryll, vägande 200–750 kilo/styck, som först påträffades i de omfattande skrotstenshögarna, kunde spåras till fast klyft i gruvans djupare delar.
Användning
Berylliummetall används i lätta metallegeringar som främst används inom rymdindustri, och som legeringsämne till koppar, berylliumbrons. Vidare används metallen till fönster i röntgenrör och som moderatormaterial och för kapsling i kärnreaktorer. I kärnvapen används beryllium som neutronreflektor. Berylliumoxid är en elektrisk isolator med hög värmeledningsförmåga. Dessa egenskaper utnyttjas i en pasta, som anbringas mellan värmekänsliga komponenter på kretskort och kylflänsar för att ge god termisk kontakt utan isolationsproblem.
All användning av beryllium begränsas av dess giftighet.

| H-fraser | H350i, H330, H301, H372, H319, H335, H315, H317 |
|---|---|
| P-fraser | P201, P260, P280, P284, P301+310, P305+351+338 |
http://www.periodicvideos.com/















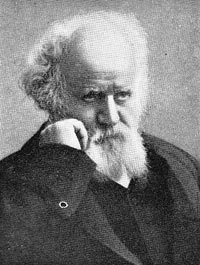









































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































































Kommentarer